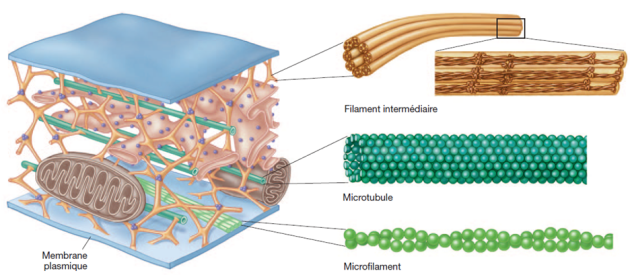
On appelle cytosquelette le réseau de filaments protéiques qui parcourent le cytoplasme et qui confèrent à la cellule ses propriétés mécaniques.
Généralités⚓
Commençons par revoir les principales caractéristiques du cytosquelette en travaillant à partir ce cette vidéo (seulement les 2 premières parties. Les autres sont un peu trop complexes ; les caractéristiques des différents filaments seront vues avec d'autres supports)
Rôles du cytosquelette⚓
Le cytosquelette est responsable de :
la forme des cellules
la répartition des organites
les mouvements cellulaires (flagelle, contraction)
le déplacement des chromosomes à la mitose
Les constituants du cytosquelette⚓
Structure et dynamique du cytosquelette⚓
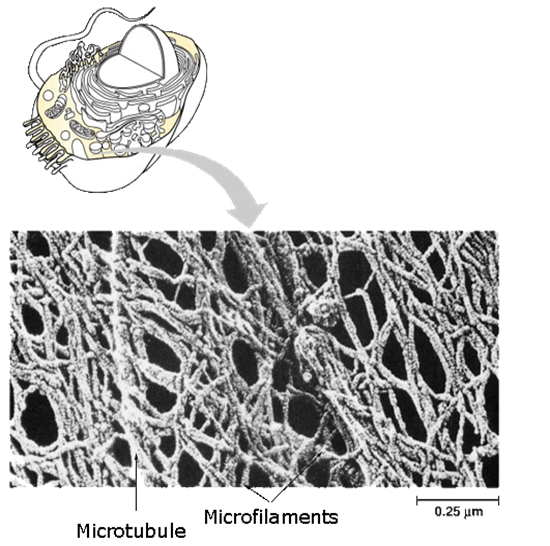
Les filaments du cytosquelette sont des polymères orientés. Les monomères qui les constituent peuvent être globulaires (actine des microfilaments, tubuline des microtubules) ou fibreux (kératine des filaments intermédiaires par exemple)
Les microtubules et les microfilaments sont des structures dynamiques en remaniement constant en fonction des besoins de la cellules
Les microfilaments⚓
Structure des microfilaments⚓
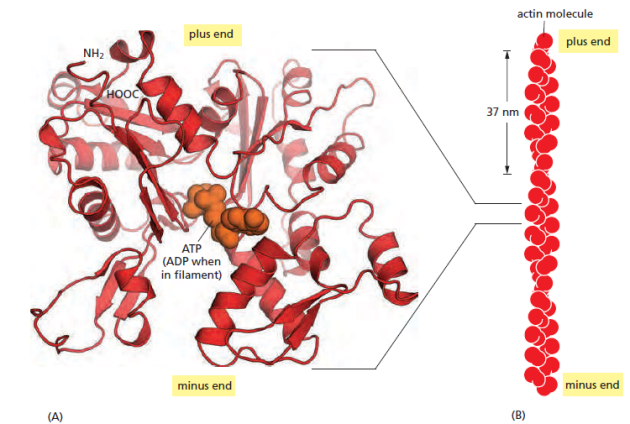
Les filaments d'actine (actine F), également appelés microfilaments, sont des filaments fins de 7 nm de diamètre constitués de la polymérisation d'une protéine globulaire, l'actine G. Ils ont un aspect hélicoïdal de longueur variable et peuvent être ramifiés.
Polymérisation des filaments d'actine⚓
Visionner cette vidéo pour revoir le mécanisme de polymérisation des filaments d'actine.
Mécanisme de la polymérisation⚓
La polymérisation de l'actine fait intervenir un mécanisme de tapis roulant. Les monomères d'actine G-ATP sont incorporés à l'extrémité + du filament. L'hydrolyse de l'ATP en ADP entraîne une perte d'affinité de l'actine G-ADP qui se décroche à l'extrémité -.
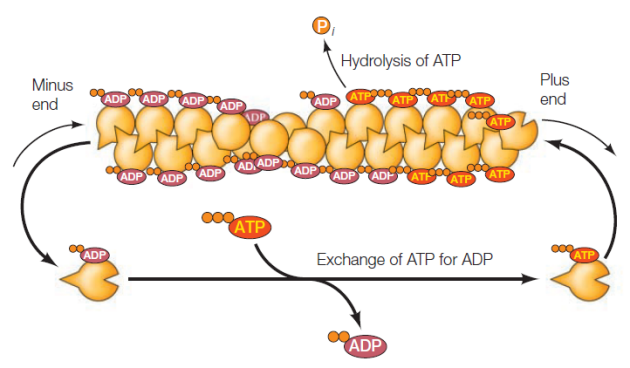
La nucléation⚓
L'assemblage des premiers monomères ou nucléation est le facteur limitant de la formation de l'actine F. En effet, les interactions ne sont pas stabilisées par la présence d'autres monomères et le "noyau" d'actine G est instable.
Cette nucléation peut être favorisée par l'intervention de protéines comme la formine. La formine est souvent localisée au niveau de la membrane plasmique et favorise la polymérisation directement sous la membrane (vous pouvez visualiser à l'aide cette animation)
La création de ramifications nécessite également la formation d'un noyau d'actine G, cette fois-ci au contact d'un filament déjà existant. Ce branchement est réalisé par le complexe Arp 2/3 (visible sur cette animation)
Arrangement des filaments d'actine⚓
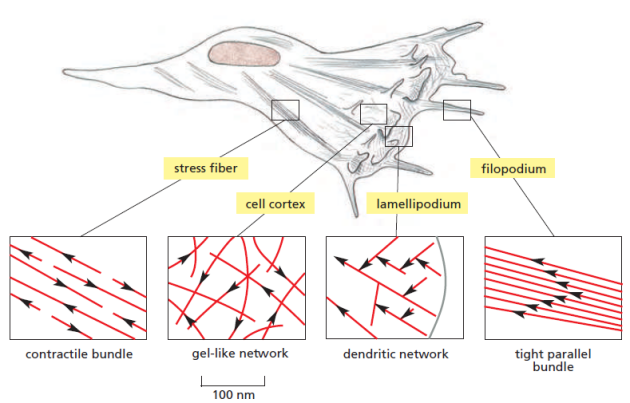
En fonction de leur localisation cellulaire et de leur rôle, les filaments d'actine ne sont pas tous arrangés de la même manière.
Les fibres de stress sont contractiles et exercent une tension dans la cellule. Le cortex d'actine consiste en un réseau gélifié qui permet la protrusion des lamellipodes à l'origine du déplacement de la cellule. Les filopodes sont des projections de la membrane plasmique qui permettent à la cellule d'explorer son environnement.
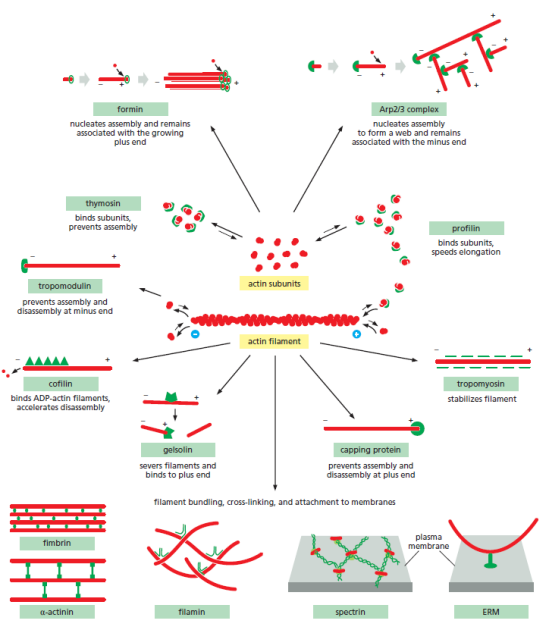
Actine et protéines accessoires⚓
Un grand nombre de protéines interagissent avec l'actine. Vous pouvez en voir quelques unes en action dans cette petite animation.
Les rôles des filaments d'actine⚓
L'actine intervient dans un grand nombre de mécanismes cellulaires :
Contraction musculaire en coulissant le long de filaments épais de myosine
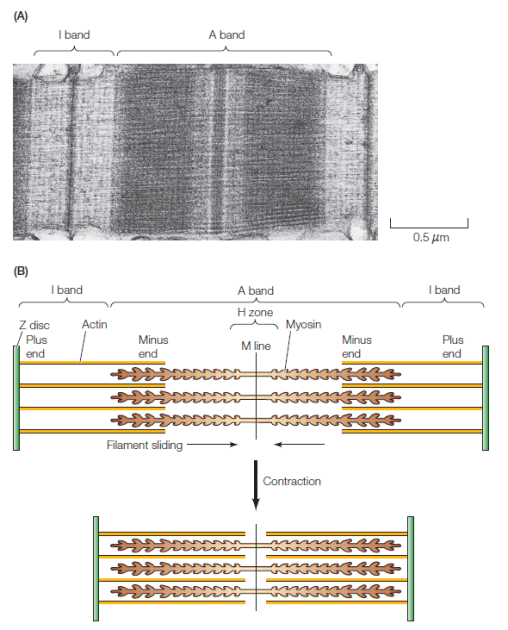
Raccourcissement des sarcomères par glissement des filaments fins d'actine le long des filaments épais de myosine | Informations[*] Formation d'un anneau contractile entre les deux cellules filles lors de la cytodiérèse
Mobilité cellulaire :
formation des pseudopodes et filopodes lors des déplacements de la cellule (mouvements amiboïdes)
endocytose et exocytose
Renforcement des épithéliums par ancrage au niveau des jonctions adhérentes
Structure des microvillosités
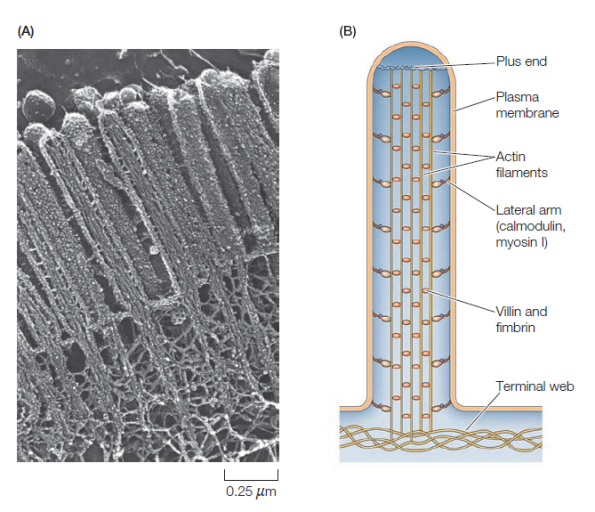
Microvillosité intestinale | Informations[*] ...
Mise en évidence du rôle des microfilaments dans les mouvements amiboïdes⚓
Expérience 1⚓
Afin de comprendre le rôle des microfilaments dans les mouvements cellulaires, on étudie l'effet de le cytochalasine B (un inhibiteur de la formation des microfilaments) sur la forme et la mobilité des amibes.
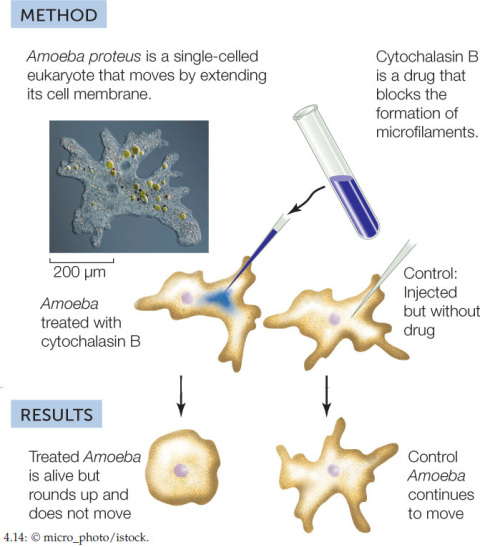
Conclusion
Expérience 2⚓
Afin de valider ces résultats expérimentaux, différents contrôles ont été réalisés.
L'expérience a été renouvelée en présence de cycloheximide qui bloque la synthèse protéique ou de colchicine qui inhibe la polymérisation des microtubules. Les résultats sont présentés dans le tableau ci-dessous.
On sait que les microfilaments sont des structures protéiques.
Interprétation des expériences
Conclusion
Les microtubules⚓
Structure des microtubules⚓
Les microtubules sont des cylindres creux de 25 nm de diamètre constitués de l'assemblage de 13 protofilaments, eux-mêmes formés de l’enchaînement d'hétérodimères de tubuline αβ.
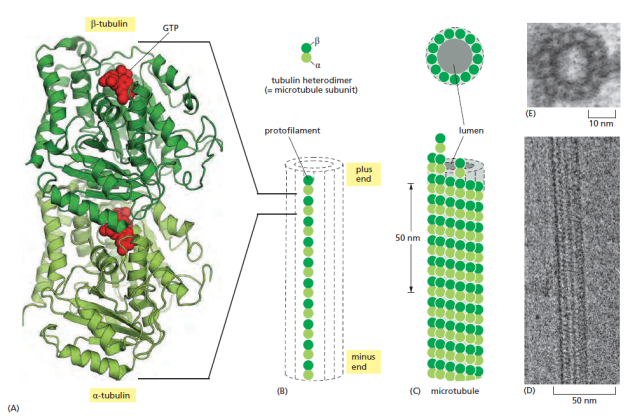
Polymérisation des microtubules⚓
Visionner cette vidéo pour revoir le mécanisme de polymérisation des microtubules.
Mécanisme de la polymérisation⚓
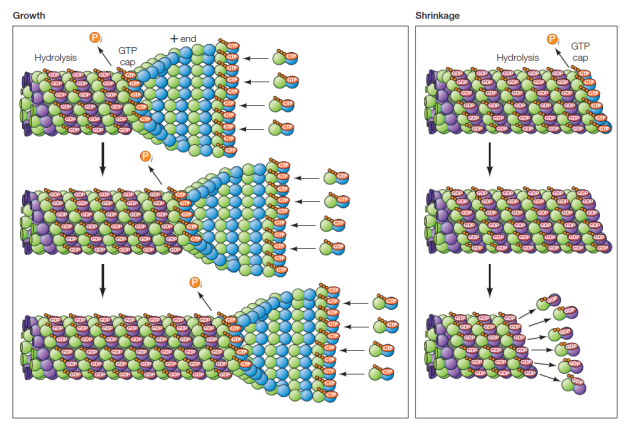
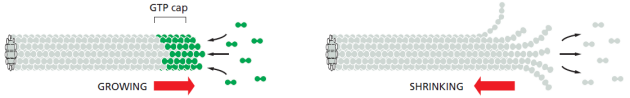
Les dimères de tubuline s'assemblent à l'extrémité "+" du microtubule pour former un feuillet qui se referme progressivement comme une fermeture éclair. Après incorporation, le GTP associé à la tubuline est hydrolysé en GDP. La tubuline-GDP perd alors son affinité pour les monomères voisins.
Si la concentration en tubuline-GTP libre diminue dans l'environnement, alors la polymérisation va ralentir et la tubuline-GDP se retrouvera à l'extrémité "+" et il y aura dissociation de la tubuline et raccourcissement du microtubule. (on parle parfois de "catastrophe")
L'alternance croissance / raccourcissement des microtubules est appelée instabilité dynamique.

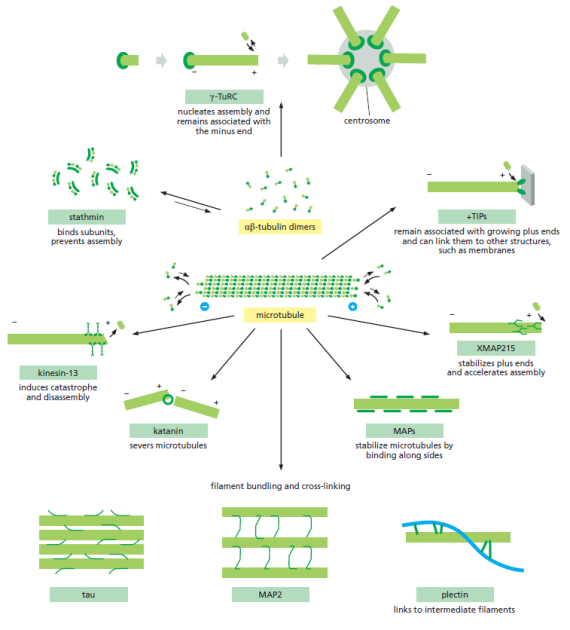
Microtubules et protéines accessoires⚓
Comme les filaments d'actines, les microtubules interagissent avec de nombreuses protéines.
Les rôles des microtubules⚓
Les microtubules sont eux aussi impliqués dans de nombreux mécanismes cellulaires :
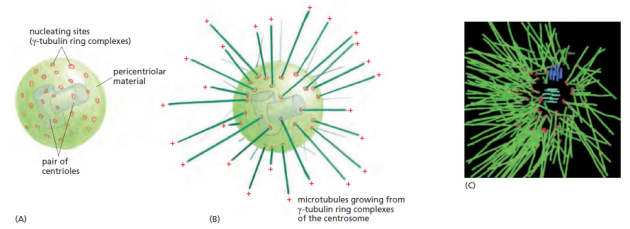
Mitose (centrioles et fuseau mitotique)
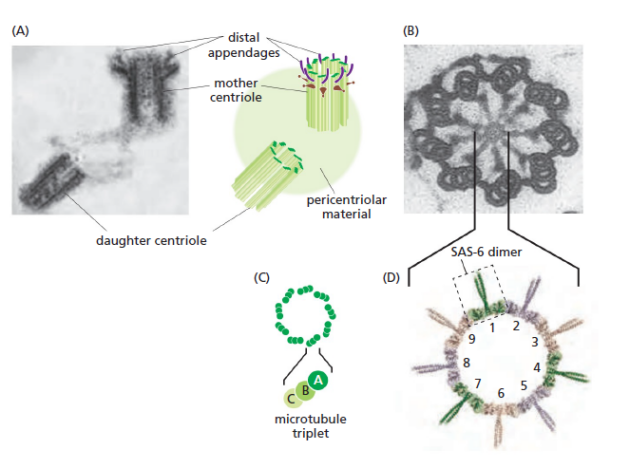
Une paire de centrioles dans le centrosome | Informations[*] Le centrosome est constitué d'une paire de centrioles entourés d'une matrice protéique amorphe au niveau de laquelle va être initiée la polymérisation des microtubules du fuseau mitotique | Informations[*] Mobilité cellulaire (flagelles et cils)
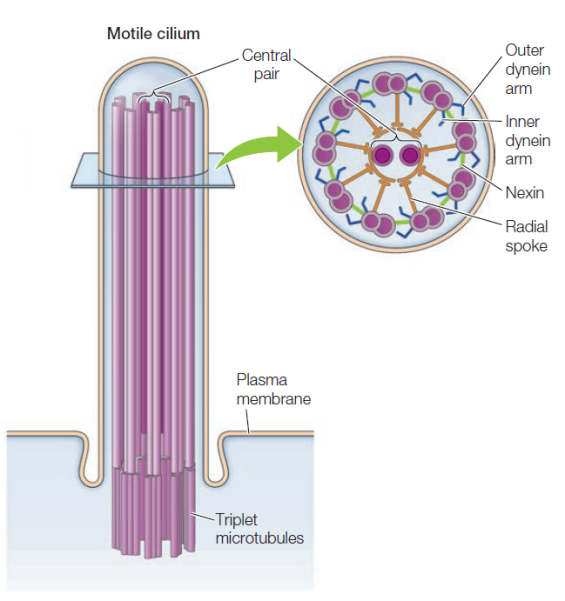
Organisation des microtubules dans les cils et flagelles | Informations[*] Transport de vésicules à l'aide de protéines accessoires également appelées "moteurs moléculaires" comme la dynéine (du + vers le -) et la kinésine (du - vers le +)
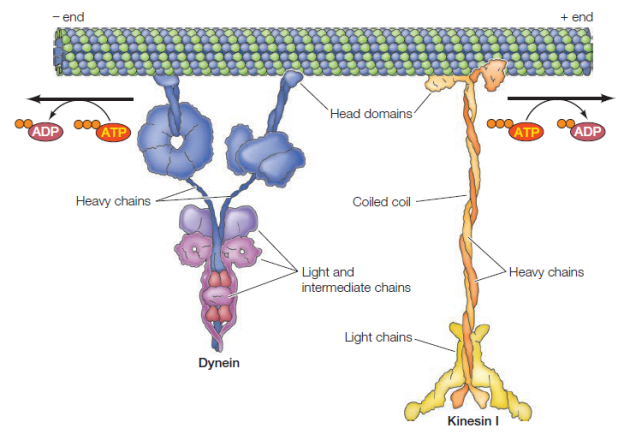
Kinésine et Dynéines : 2 moteurs protéiques permettant le transport de vésicules en sens inverse le long des microtubules | Informations[*] Vous pouvez voir le résultat d'une expérience montrant la kinésine en action et sa représentation 3D à l'aide d'animations ici, là, et là. Sur cette petite vidéo assez drôle (ça reste relatif !), on suit les aventures de John, une kinésine, transportant sa vésicule synaptique le long d'un axone.
Les filaments intermédiaires⚓
Les filaments intermédiaires ne sont pas présents dans toutes les cellules animales. On les trouve en particulier dans le cytoplasme des cellules soumises à un stress mécanique. Ils sont par contre absents chez la plupart des organismes présentant un exosquelette (arthropodes par exemple)
Contrairement à l'actine et la tubuline qui sont hautement conservées dans toutes les cellules animales, les différentes familles de filaments intermédiaires sont très diverses.
On a identifié plus de 70 gènes différents chez l'homme, classés en 4 types :
les lamines (dans le noyau)
les kératines (dans les cellules épithéliales)
les neurofilaments (dans les neurones)
les filaments apparentés à la vimentine (dans les cellules musculaires, cellules gliales, cellules mésenchymateuse, etc.)
Structure des filaments intermédiaires⚓
Les filaments intermédiaires ont un diamètre de 10-12 nm et sont constitués de la polymérisation de polymères fibreux.
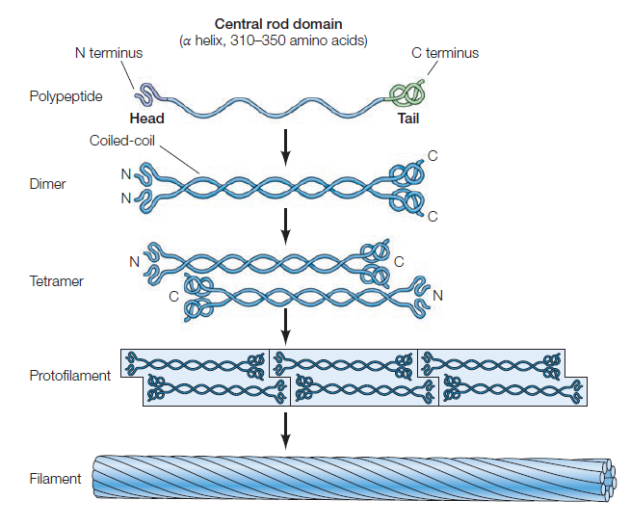
Rôle des filaments intermédiaires⚓
Les filaments intermédiaires ne sont pas impliqués dans les mouvements de la cellule mais apportent un support mécanique
En bref, ce qu'il faut retenir...⚓
Un certain nombre de paramètres sont communs aux microfilaments et aux microtubules (les filaments intermédiaires sont moins connus).
Cette animation 3D vous permet de revoir rapidement le cytosquelette (la résolution n'est pas très bonne, mais la vidéo est belle).
Localisation et rôles des filaments du cytosquelette⚓
Vous trouverez ici un tableau récapitulatif simplifié des principales caractéristiques des 3 types de filaments du cytosquelette.
La nucléation⚓
Un polymère filamenteux est stabilisé par les contacts multiples entre sous-unités adjacentes. Plus il y a de monomères, plus la structure est stable.
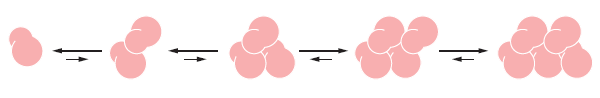
L'assemblage des premiers monomères ou "noyau" est relativement lente car ils forment une structure instable.
Les phases de la polymérisation⚓
L'assemblage d'un filament présente typiquement 3 phases :
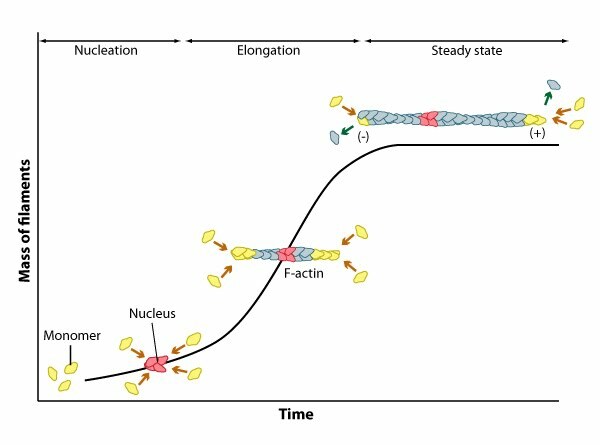
une phase de latence qui correspond au temps nécessaire à la nucléation
une phase de croissance pendant laquelle les monomères s'ajoutent aux extrémités, entraînant l'allongement du filament
une phase d'équilibre lorsque la polymérisation compense exactement la dépolymérisation
Ces étapes dépendent de la concentration en monomères dans le milieu.
Complément :
La vitesse de dissociation est constante (koff) mais la vitesse d'addition dépend de la concentration (kon.C).
La concentration critique Cc correspond à la concentration à laquelle l'équilibre est atteint soit kon.Cc = koff.
On a donc Cc = kon/koff = Kd où Kd est la constante de dissociation.
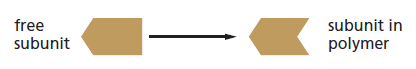
Des filaments polarisés⚓
Les 2 extrémités des filaments du cytosquelette polymérisent à des vitesses différentes. L'extrémité "rapide" est appelée extrémité "+" et l'extrémité lente est appelée extrémité "-".
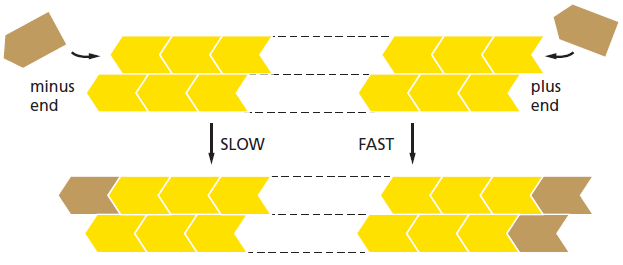
Hydrolyse des nucléotides⚓
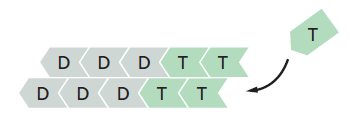
Les monomères sont liés à un nucléotide triphosphate (ATP pour l'actine G et GTP pour la tubuline). Ce monomère est hydrolysé en nucléotide diphosphate peu après son intégration dans le polymère
La forme hydrolysée a moins d'affinité et va se dissocier plus facilement.
Dynamique des filaments du cytosquelette⚓
On connaît 2 mécanismes impliqués dans le renouvellement des filaments du cytosquelette :
le "tapis roulant" plus important dans les microfilaments d'actine
et l'"instabilité dynamique" prépondérante dans les microtubules
Ces 2 phénomènes sont associés à l'hydrolyse du nucléotide triphosphate
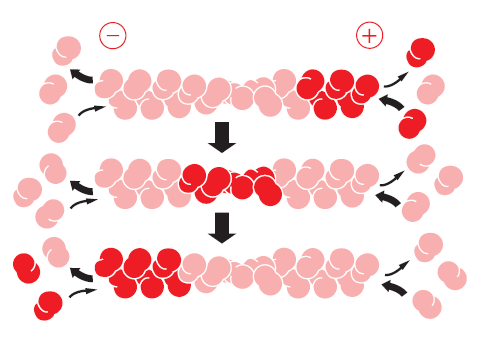
La polymérisation en "tapis roulant" du filament d'actine⚓
L'hydrolyse de l'ATP associé à l'actine G diminue l'affinité du monomère pour le polymère. Il va y avoir assemblage à l'extrémité "+" et dissociation à l'extrémité "-".
L'instabilité dynamique des microtubules⚓
Les microtubules dépolymérise 100 fois plus vite à une extrémité contenant de la GDP-tubuline qu'à une extrémité contenant de la GTP-tubuline.
Les microtubules peuvent donc alterner entre des périodes de croissance lente et des périodes de désassemblage rapide. On parle d'instabilité dynamique.
Exercice d'application⚓
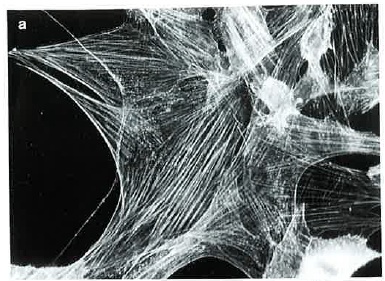
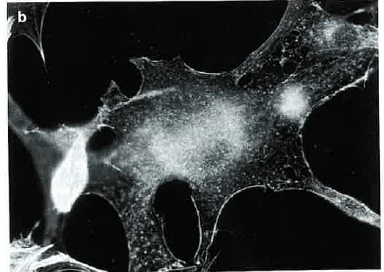
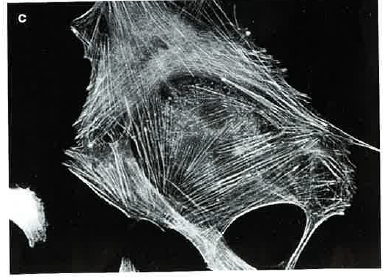
Effet de l'ionomycine sur le cytosquelette de fibroblastes
L'ionomycine est un canal calcique qui augmente la perméabilité de la membrane plasmique aux ions calcium. On étudie l'effet d'un traitement de 1 ou 10 minutes à 100 nmol/l d'ionomycine sur le cytosquelette de fibroblastes en culture.
Les résultats sont les suivants :